Data integrity dans l’industrie pharmaceutique : les engagements d’INOKY

Dans le secteur pharmaceutique, la data integrity est un pilier fondamental pour garantir la qualité, la sécurité et l’efficacité des produits. Elle est étroitement liée aux exigences réglementaires telles que la 21 CFR Part 11 ou les recommandations de l’ANSM et de la FDA. Conscient de ces enjeux, INOKY a fait de la data integrity une priorité absolue dans la conception de ses logiciels.
Aux origines de l’engagement d’INOKY pour la data integrity
Dès 1995, INOKY se voit confier par le PDG de Merck la mission de développer un système de gestion de la qualité pour les laboratoires. L’objectif ? Permettre aux responsables qualité de répondre plus rapidement et plus précisément aux audits. Cette commande initie une dynamique d’excellence qui ne cessera de croître.
En 1997, INOKY établit son tout premier document de validation pour un LIMS, chez Hoechst Marion Roussel. Ce document, qui ne faisait que 6 pages, est le témoin d’une époque où les standards étaient bien différents. Cette expérience a posé les bases d’une expertise approfondie en validation logicielle.
L’entrée dans les années 2000 est marquée par le bug de l’an 2000, une crise qui a mobilisé l’ensemble de l’industrie pharmaceutique. Si les conséquences ne furent pas catastrophiques, elles ont accéléré une réflexion sur la sécurité des systèmes et la nécessité d’une traçabilité rigoureuse. C’est dans ce contexte qu’INOKY développe une interprétation complète de la 21 CFR Part 11, tout en améliorant significativement ses logiciels.
Intégration des exigences réglementaires : la réponse d’INOKY
En intégrant les principes de la 21 CFR Part 11, INOKY renforce plusieurs aspects de ses solutions :
- Authentification sécurisée par mot de passe renforcé
- Audit trail enrichi, garantissant une traçabilité complète
- Refonte du workflow et de la signature électronique, adaptée aux exigences des autorités
Ces efforts aboutissent, en 2006, à la validation d’INOKY sur plusieurs sites de cinq grands groupes pharmaceutiques français. INOKY devient alors le premier système informatisé validé sur ces sites.
Data integrity : des améliorations constantes au service de la conformité
INOKY poursuit ses innovations pour garantir une data integrity robuste. Parmi les évolutions majeures :
- Division des rôles d’administration : INOKY distingue les KeyUsers (administrateurs fonctionnels qui paramètrent les droits) des administrateurs informatiques (qui attribuent ces droits). Cette séparation des pouvoirs est un gage de conformité avec les attentes de la FDA et de l’ANSM.
- Sécurisation des accès : l’intégration de l’annuaire LDAP et le renforcement des mots de passe permettent une authentification fiable. La signature électronique est intégrée de manière fluide aux processus de validation.
- Audit trail avancé : la version 8.1b de LABSTOCK introduit une traçabilité contextuelle, conforme aux principes ALCOA. Elle permet de retracer des actions sensibles, comme la modification de la DLUO d’un article stocké selon les zones de stockage.
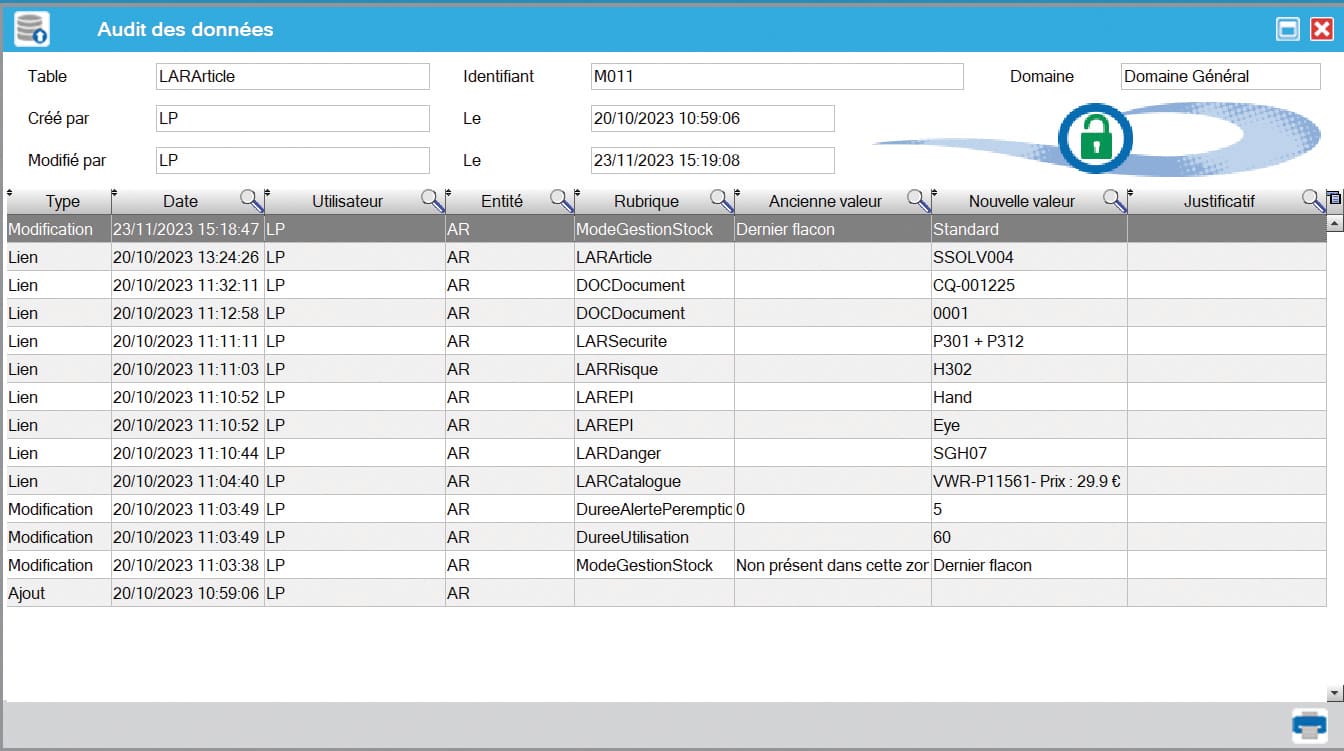
Vers un système toujours plus transparent et auditable
La démarche d’amélioration continue d’INOKY ne s’arrête pas là :
- Les interfaces de revue d’audit trail sont optimisées pour faciliter l’analyse par les responsables qualité.
- De nouvelles fonctionnalités sont développées pour rendre la revue des données plus intuitive et rapide.
Depuis plus de 25 ans, INOKY est engagé dans une démarche rigoureuse de conformité, s’adaptant continuellement aux exigences réglementaires les plus strictes. La data integrity n’est pas un simple concept : c’est une pratique concrète et vérifiable dans chaque fonctionnalité logicielle.